- Autor Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:06.
- Última modificación 2025-01-23 12:16.
La dilución es el proceso de diluir más una solución concentrada. Hay una variedad de razones por las que alguien podría querer hacer una dilución, desde razones serias hasta simples. Por ejemplo, los bioquímicos diluyen soluciones a partir de sus formas concentradas para hacer nuevas soluciones para usar en experimentos, mientras que, por otro lado, los camareros a menudo diluyen el licor con refrescos o jugos para hacer que los cócteles sean más sabrosos. La fórmula general para calcular la dilución es C1V1 = C2V2, con C1 y C2 representa las concentraciones inicial y final de la solución, respectivamente, y V1 y V2 representa el volumen.
Paso
Método 1 de 2: dilución precisa de concentrados mediante la ecuación de dilución

Paso 1. Determine lo que sabe y lo que no sabe
La dilución en química generalmente significa tomar una pequeña cantidad de una solución cuya concentración conoce, luego agregar un líquido neutro (como agua) para hacer una nueva solución con un volumen más grande pero una concentración más baja. Esto se hace muy a menudo en los laboratorios de química porque, en aras de la eficacia, los reactivos a menudo se almacenan en concentraciones muy altas, que luego se diluyen para su uso en experimentos. Por lo general, en la mayoría de las situaciones del mundo real, sabrá la concentración de su solución inicial y la concentración o volumen que desea que sea su concentración final, pero no el volumen de solución inicial que necesita para obtener la solución final.
- Sin embargo, en otras situaciones (especialmente en problemas escolares), es posible que deba encontrar otras piezas del rompecabezas; por ejemplo, se le puede dar un volumen y concentración inicial, y luego se le pedirá que encuentre la concentración final si diluye una solución. al volumen deseado. En cualquier caso de dilución, es útil anotar las variables conocidas y desconocidas antes de comenzar.
-
Terminemos las preguntas de ejemplo. Suponga que se nos pide que diluyamos una solución 5 M con agua para hacer 1 L de una solución 1. mM. En este caso, conocemos la concentración de nuestra solución inicial y el volumen y concentración final que queremos, pero no la cantidad de solución inicial que necesitamos agregar con agua para lograr el resultado deseado.
Recordatorio: En química, M es una medida de concentración llamada Molaridad, que denota los moles de una sustancia por litro
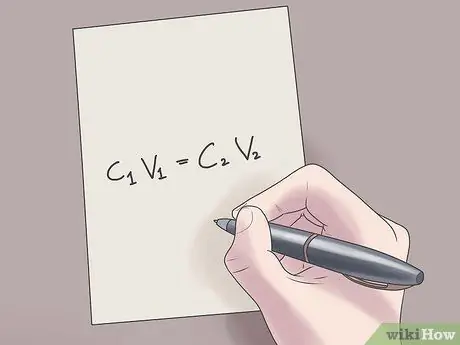
Paso 2. Inserta tus valores en la fórmula C1V1 = C2V2.
En esta fórmula, C1 es la concentración inicial de la solución, V1 es el volumen de la solución inicial, C2 es la concentración final de la solución, y V2 es el volumen de la solución final. Insertar valores conocidos en esta ecuación le ayudará a encontrar valores desconocidos con menos dificultad.
- Puede resultarle útil poner un signo de interrogación delante de la unidad que desea buscar para ayudarlo a resolverlo.
-
Continuemos con nuestro ejemplo. Ingresaremos los valores que conocemos de la siguiente manera:
- C1V1 = C2V2
- (5 M) V1 = (1 mM) (1 L). Nuestras dos concentraciones tienen diferentes unidades. Detengámonos aquí y pasemos al siguiente paso.

Paso 3. Considere las diferencias de unidades
Dado que las soluciones implican cambios en la concentración (que a veces pueden ser bastante grandes), no es inusual que las dos variables en su ecuación tengan unidades diferentes. Si bien esto es fácil de pasar por alto, las unidades desiguales en su ecuación pueden hacer que su respuesta sea incorrecta. Antes de terminar, convierta todos los valores con diferentes unidades de concentración y / o volumen.
-
En nuestro ejemplo, usamos diferentes unidades para las concentraciones de M (molares) y mM (milimolares). Cambiemos nuestra segunda medida a M:
- 1 mM × 1 M / 1,000 mM
- = 0,001 M

Paso 4. Termina
Una vez que todas las unidades sean iguales, resuelve tu ecuación. Esto casi siempre se puede hacer con álgebra simple.
-
Paramos nuestro problema de ejemplo aquí: (5 M) V1 = (1 mM) (1 L). Encontremos el valor de V1 con nuestra nueva unidad.
- (5 M) V1 = (0,001 M) (1 L)
- V1 = (0,001 M) (1 L) / (5 M).
-
V1 = 0,0002 L o 0,2 mL.

Paso 5. Comprenda cómo usar su respuesta correctamente
Digamos que ha encontrado su valor faltante, pero no está seguro de cómo usar esta nueva información en la dilución real que necesita hacer. Esto es comprensible: el lenguaje de las matemáticas y las ciencias a veces no coincide con el mundo real. Cuando conoces los cuatro valores de la ecuación C1V1 = C2V2, realice la dilución de la siguiente manera:
- Mide el volumen V1 de una solución con una concentración de C1. Luego, agregue suficiente diluyente (agua, etc.) para hacer que el volumen total V2. Esta nueva solución tendrá la concentración que desee (C2).
- En nuestro ejemplo, por ejemplo, primero medimos 0.2 mL de una solución de 5 M. Luego, agregaremos suficiente agua para aumentar el volumen de la solución a 1 L: 1 L - 0.0002 L = 0.9998 L, o 999, 8 mL. En otras palabras, agregaremos 999.8 mL de agua a nuestra pequeña solución de muestra. Nuestra nueva solución diluida tiene una concentración de 1 mM, que es nuestra concentración deseada.
Método 2 de 2: hacer una solución de dilución simple y práctica

Paso 1. Lea cualquier empaque para obtener información
Hay una variedad de razones por las que es posible que desee preparar una solución de dilución en casa, en la cocina o en otro laboratorio no químico. Por ejemplo, hacer jugo de naranja a partir de un simple concentrado es una dilución. En muchos casos, el producto que debe diluirse contiene información sobre la dilución que debe realizarse, en algún lugar del envase. Es posible que tengan instrucciones precisas a seguir. A continuación, se incluyen algunos aspectos que debe tener en cuenta al buscar información:
- Volumen de producto utilizado
- Volumen de diluyente utilizado
- Tipo de diluyente utilizado (generalmente agua)
- Instrucciones especiales de mezcla
- Es posible que no vea información sobre la concentración exacta del líquido utilizado. Esta información no es útil para el consumidor medio.

Paso 2. Agregue la sustancia que actúa como diluyente a la solución concentrada
Para diluciones caseras simples, como las que puede hacer en la cocina, solo necesita saber el volumen de concentrado que está usando y la concentración final aproximada que desea antes de comenzar. Diluir el concentrado con una cantidad adecuada de diluyente, que se determina en función del volumen del concentrado inicial utilizado. Vea abajo:
- Por ejemplo, si quisiéramos diluir 1 taza de concentrado de jugo de naranja a 1/4 de su concentración inicial, agregaríamos 3 tazas agua en el concentrado. Nuestra mezcla final tendrá 1 taza de concentrado en 4 tazas de líquido completo, 1/4 de su concentración inicial.
- Aquí hay un ejemplo más complicado: si quisiéramos diluir 2/3 de taza de concentrado a 1/4 de su concentración inicial, agregaríamos 2 tazas de agua, porque 2/3 de taza es igual a 1/4 de 2 y 2/3 de taza de la líquido entero.
- Asegúrese de agregar su sustancia en un recipiente lo suficientemente grande como para contener el volumen final que desea: un recipiente grande o un recipiente similar.

Paso 3. Ignore el volumen de polvo en la mayoría de los casos
Agregar un polvo (como ciertas mezclas de bebidas) a un líquido generalmente no se considera una dilución. El cambio de volumen resultante de la adición de una pequeña cantidad de polvo al líquido suele ser lo suficientemente pequeño como para ser insignificante. En otras palabras, cuando agregue una pequeña cantidad de polvo a un líquido, simplemente agregue el polvo al volumen final deseado de líquido y mezcle.
Advertencia
- Siga las pautas de seguridad proporcionadas por el fabricante o requeridas por su empresa. Esto es especialmente importante si tiene que diluir la solución ácida.
- Trabajar con soluciones ácidas puede requerir medidas y pautas de seguridad más detalladas que con soluciones no ácidas.






